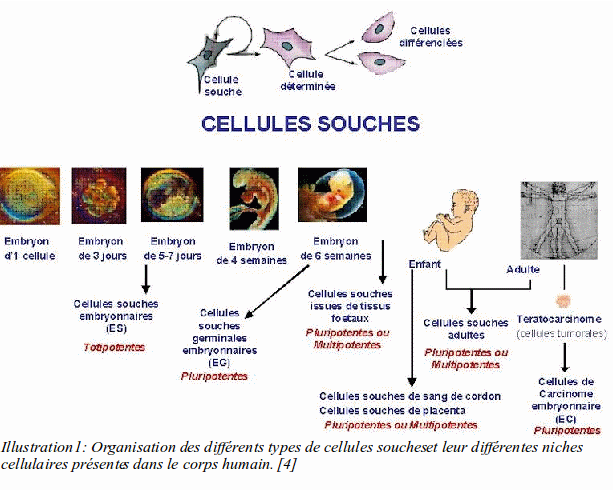
Pendant des décennies, l'extraction de germes a été indiquée très souvent à but prophylactique. Or on a vu que la plupart des recommandations officielles déconseillent en l'absence de preuves fondamentales, l'extraction des germes, le plus souvent. Un renouveau de ces extractions viendrait en fait de l'utilisation de ces germes. Jusqu'à maintenant on pouvait s'en servir pour la recherche, ce qui n'est pas suffisant pour indiquer l'extraction. Mais à l'heure actuelle ou dans un futur proche, nous pourrons les utiliser pour des thérapies. Cela entraînera une réévaluation du rapport bénéfice risque.
Elles
sont présentes au stade embryonnaire et dans l'organisme adulte,
mais elles sont bien plus rares dans l'organisme adulte (citons
les cellules souches hématopoïétiques régénérant en continu les
cellules du sang, les cellules souches intestinales, les cellules
souches nerveuses dans des régions précises du cerveau (hippocampe,
zone subventriculaire)).
De
manière générale, les cellules souches sont présentes chez tous
les êtres vivants pluricellulaires. Elles jouent un rôle très
important dans le développement des organismes ainsi que dans leur
maintien. [14]
Il existe plusieurs types de cellules souches en fonction de leur potentiel de différenciation :

Les cellules souches d'origine dentaire sont des cellules souches adultes multipotentes.
Il se trouve dans la dent et son environnement plusieurs niches cellulaires. Les niches cellulaires sont les endroits spécifiques contenant les facteurs physiologiques nécessaires pour garder une cellule indifférenciée.
Dans la pulpe dentaire des troisièmes molaires, des Mesenchymal Stem Cells (Cellules Souches Mésenchymateuses : MSCs) sont présentes avec plusieurs dérivés comme les Dental Pulp Stem Cells (DPSCs), les Stem Cells from Human Exfoliated Deciduous Teeth ou SHED dans les dents temporaires et les Periodontal Ligament Stem Cells ou PDLSCs. Ces trois dernières cellules ont montré in-vivo qu'elles avaient les mêmes potentialités que les MSCs classiques. [13]
Actuellement les cellules de sang de cordon sont prélevées et conservées. Et aux États-Unis, selon les états, cela peut constituer un délit de ne pas le proposer à une femme enceinte. [2]
Actuellement, avec comme base des cellules souches on peut régénérer différents tissus. Il y a beaucoup d'espoir dans les possiblilités de traitements de certaines maladies comme la maladie de Parkinson ou la maladie d'Alzheimer. [2]
La régénération tissulaire pourrait donner une régénération de tissus cardiaques et musculaires, un plus dans le traitement des maladies neuro-dégénératives, une régénération, reconstructive de tissus osseux et de cartilages, un plus dans le traitement de maladies métaboliques (foie, pancréas), des maladies dégénératives de la rétine et de la cornée, de l’ischémie par vascularogenèse, un plus dans l'induction de l’angiogenèse, dégénération de tissus irradiés lors d’un traitement par irradiation...
Les cellules souches d'origine dentaire au niveau des dents déciduales, les SHED, ont montré in vitro une capacité de différenciation en cellules neuronales et notamment en neurones actifs avec des potentiels électriques égaux aux potentiels électriques d'une cellule normale. Les SHED ont montré également, un potentiel de régénération vasculaire à explorer. [1] [10]
Plus particulièrement au niveau des cellules souches de dents de sagesses, des études ont montré que la cryoconservation est bonne, et est plus simple qu'avec des cellules souches provenant de la moelle osseuse. Par exemple, avec une pulpe de troisième molaire après multiplication, nous pouvons obtenir une prolifération de ces cellules, et une transformation en pré-odontoblastes qui peuvent produire une matrice minéralisée. [5]
Sur la cryoconservation, les cellules souches d’origine dentaire ont été comparées avec des cellules souches d'origine osseuse et après cryogénisation, leur potentiel multiplicatif reste largement suffisant pour être utilisable dans une quelconque thérapie cellulaire. [12]
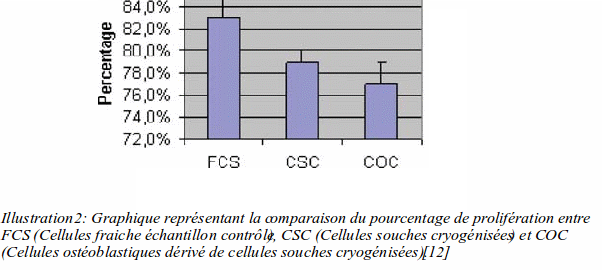
On voit sur le graphique que la perte de pourcentage de prolifération est minime et non statistiquement significative entre les cellules souches fraîches et les cellules souches cryogénisées. [12]
Avec des cellules souches dérivées d'une troisième molaire incluse, une équipe a démontré qu'il était possible de redonner une activité hépatique à un foie de rat atteint de cirrhose. Cette étude est très prometteuse en ce qui concerne les avancées possibles de la thérapie cellulaire sur les maladies métaboliques hépatiques. [9]
Des cellules souches de pulpe (DPSCs) de troisièmes molaires incluses ont été introduites dans des cerveaux de souris ayant eu une ischémie cérébrale entraînant une diminution de l'activité neuronale. Chez les souris test, il a été démontré une reprise de l'activité neuronale, significativement plus importante que dans le groupe n'ayant pas reçu de traitement. [7]
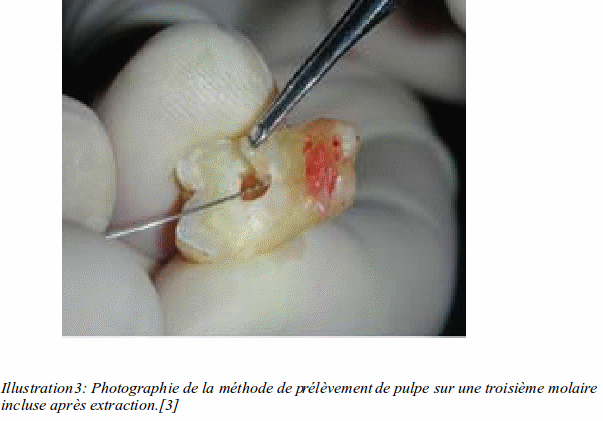
Au niveau des applications dentaires, l'expérience suivante a été décrite offrant des résultats assez prometteurs. [3] Il a été extrait des germes de troisièmes molaires maxillaires dont les cellules souches ont été récupérées. Ensuite les troisièmes molaires mandibulaires ont été extraites entraînant un grand défaut osseux en distal de la seconde molaire mandibulaire. Ce défaut osseux a été comblé par un complexe formé d'un support collagénique imprégné de DPSCs d'un côté et de l'autre uniquement une éponge de collagène. Les résultats à 7 jours ne montrent pas de différences significatives.
Au bout de 30 jours, un sondage parodontal en distal de la deuxième molaire montre qu'il y a eu une régénération osseuse bien plus importante du côté ou il y a le complexe que du côté ou il n'y a que l'éponge de collagène. De plus, après forage osseux et analyse histologique, la qualité de l'os trouvé côté traité par DPSCs est bien meilleure que de l'autre. Il y a de véritables canaux haversiens du côté traité par le complexe éponge collagénique et DPSCs, alors que de l'autre côté l'os présente de nombreuses lacunes vides. [3]
Il est possible d'utiliser les cellules souches d'origine dentaire pour réparer les structures dentaires chez la souris. Par exemple, avec les DPSCs et les SHED, les chercheurs peuvent créer des dérivés tissulaires dentinaires et pulpaires. Avec les PDLSCs une synthétisation de cément ou de fibres composant le desmodonte est possible.
Les cellules souches d'origine dentaire sécrètent, à leur surface membranaire, les mêmes marqueurs que les MSCs classiques.
De manière générale, les MSCs dentaire peuvent donner de la dentine, de l'os, des cellules musculaires du péricarde, du tissu neural, voire des cellules de l'endothélium. [13]
Dans un germe dentaire, plusieurs niches cellulaires peuvent coexister.
La pulpe de la dent est composée de trois couches cellulaires. Il y a la couche odontoblastique avec les odontoblastes qui envoient leurs prolongements odontoblastiques dans les tubuli dentinaires. Puis la couche acelllulaire de Weill, qui est une couche ne contenant que très peu de cellules et beaucoup de tissus fibreux. Et enfin, la troisième couche où peuvent se trouver des cellules indifférenciées comme les DPSCs. C'est cette troisième couche, appelée la couche riche en cellules, qui représente une niche cellulaire. [5]
La niche cellulaire est une structure en trois dimensions, fixe, contenant les éléments participant à la prolifération de la cellule souche, à son contrôle et à sa régulation. [8]
Les autres niches se trouvent dans la zone péri-apicale avec les Stem Cells from Apical Papilla ou SCAP, le ligament parodontal avec les Periodontal Ligament Stem Cells ou PDLSCs, et enfin dans le sac folliculaire aevc les Dental Follicle Precursor Cells ou DFPCs.
Les cellules DFPCs, comme leur nom l'indique, sont des cellules précurseurs, déjà engagées dans une voie de différenciation.
Dans le sac folliculaire, on trouve les DFPCs : elles peuvent donner uniquement des structures dentaires, vu leur état de différenciation avancée, car ce sont des cellules progénitrices qui sont engagées dans une voie de différenciation. Les DFPCs sont régulées par les protéines amélaires qui peuvent faire se différencier ces cellules en cémentoblastes ou ostéoblastes. [6]
Les DFPCs sont uniquement présentes en phase éruptive et peuvent également donner des cellules du ligament parodontal, résultats obtenus sur des germes de troisième molaire. [11]
In vitro, avec les DFPCs, on peut obtenir des adipocytes et des neurones. L'auteur avance la thèse que ce serait la présence d'autres MSCs présentes dans le sac folliculaire qui en seraient responsables. [15]
Les SCAP sont également les seules cellules souches qui ne peuvent être présentes que dans la dent à l'état de germe. Ce sont des cellules situées dans la partie apicale de la racine en cours de formation.
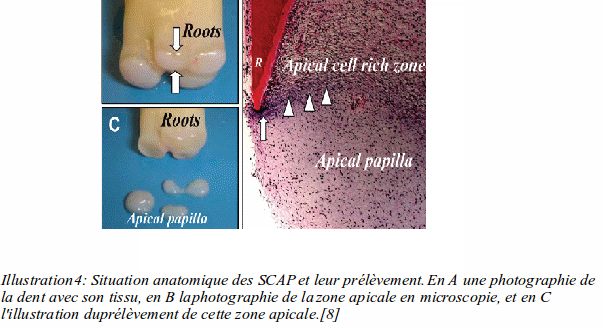
Les SCAP se trouvent dans la zone apicale d'une molaire en formation comme nous pouvons le voir sur l'Illustration 4.
Nous avons vu au chapitre que de récents progrès permettent de conserver des cellules souches et que nous sommes très proche d'applications humaines in-vivo pour les thérapies cellulaires. La possibilité de conservation permettrait de prévoir et de prévenir à l'avance les problèmes de certaines maladies. Ces maladies pouvant être plus tard soignées par thérapies cellulaires.
Concrètement, en France, l'institut Clinident® permet l'envoi au praticien de caisses contenant de l'azote liquide pour la conservation des organes dentaires. Le praticien envoie le prélèvement à Clinident®. Cet institut va conditionner le prélèvement et l'envoyer dans un centre en localisé Allemagne (IBMT Fraunhafer). Les flacons de conservation, identifiés par code barre, sont portés de façon progressive à une température de -196°C dans un conteneur d’azote liquide garantissant des conditions de stockage et de sécurité adéquat pendant 20 ans et plus s'il y a reconduction du contrat.
Le service coûte au patient 2440 euros et inclut la conservation simultanée de 1 à 2 dents pulpées pendant 20 ans.
Les avancées médicales dans le domaine de la thérapie cellulaire entraînent de nouvelles perspectives en ce qui concerne les extractions dentaires en général, avec les perspectives de conservation et les objectifs des scientifiques à développer et mettre en place les traitements (qui à l'heure actuelle ne sont pas opérationnels).
Du point de vue éthique, si on compare avec les cellules souches d'origine embryonnaire, les problèmes seront de fait bien moins importants.
Du point de vue technique, on parle de greffe autologue, les thérapeutes s’affranchissant de tous les problèmes de compatibilité entre systèmes immunitaires et/ou de rejets de greffes.
Les extractions à but prophylactique, notamment sur le plan orthodontique, manquaient de preuves fondammentales; nous pouvons dire que les extractions à but de conservation tissulaire par des organismes tiers réalisent aujourd'hui une nouvelle indication sur les germectomies prophylactiques de troisièmes molaires asymptomatiques.
Ce type de thérapeutique donne une utilité à l'extraction et au produit biologique que l'on en retire. C'est donc sur le même niveau éthique et médical qu'une prise de sang, ou tout autre prélèvement biologique.
Bibliographie
[1] Arthur A, Rychkov G, Shi S, Koblar SA & Gronthos S. Adult human dental pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues. Stem Cells (2008) 26: 1787-95.
[2] Canal P, Favre de Thierrens C & Cuisinier F. Place de la dent de sagesse, Journées Odontologiques Internationales de Montpellier. Montpellier Le Corum (2010)
[3] d'Aquino R, De Rosa A, Lanza V, Tirino V, Laino L, Graziano A, Desiderio V, Laino G & Papaccio G. Human mandible bone defect repair by the grafting of dental pulp stem/progenitor cells and collagen sponge biocomplexes. Eur Cell Mater (2009) 18: 75-83.
[4] Genethique, (décembre 2000) Disponible sur http://www.genethique.org/doss_theme/dossiers/cellules_souches/def_cellules_souches.htm
[5] Graziano A, d'Aquino R, Laino G & Papaccio G. Dental pulp stem cells: a promising tool for bone regeneration. Stem Cell Rev (2008) 4: 21-6.
[6] Hakki SS, Berry JE & Somerman MJ. The effect of enamel matrix protein derivative on follicle cells in vitro. J Periodontol (2001) 72: 679-87.
[7] Huang AH, Snyder BR, Cheng P & Chan AWS. Putative dental pulp-derived stem/stromal cells promote proliferation and differentiation of endogenous neural cells in the hippocampus of mice. Stem Cells (2008) 26: 2654-63.
[8] Huang GT, Gronthos S & Shi S. Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. J Dent Res (2009) 88: 792-806.
[9] Ikeda E, Yagi K, Kojima M, Yagyuu T, Ohshima A, Sobajima S, Tadokoro M, Katsube Y, Isoda K, Kondoh M, Kawase M, Go MJ, Adachi H, Yokota Y, Kirita T & Ohgushi H. Multipotent cells from the human third molar: feasibility of cell-based therapy for liver disease. Differentiation (2008) 76: 495-505.
[10] Iohara K, Zheng L, Wake H, Ito M, Nabekura J, Wakita H, Nakamura H, Into T, Matsushita K & Nakashima M. A novel stem cell source for vasculogenesis in ischemia: subfraction of side population cells from dental pulp. Stem Cells (2008) 26: 2408-18.
[11] Morsczeck C, Götz W, Schierholz J, Zeilhofer F, Kühn U, Möhl C, Sippel C & Hoffmann KH. Isolation of precursor cells (PCs) from human dental follicle of wisdom teeth. Matrix Biol (2005) 24: 155-65.
[12] Papaccio G, Graziano A, d'Aquino R, Graziano MF, Pirozzi G, Menditti D, De Rosa A, Carinci F & Laino G. Long-term cryopreservation of dental pulp stem cells (SBP-DPSCs) and their differentiated osteoblasts: a cell source for tissue repair. J Cell Physiol (2006) 208: 319-25.
[13] Shi S, Bartold PM, Miura M, Seo BM, Robey PG & Gronthos S. The efficacy of mesenchymal stem cells to regenerate and repair dental structures. Orthod Craniofac Res (2005) 8: 191-9.
[14] Wilkipedia, (2010) Disponible sur http://fr.wikipedia.org/wiki/Cellules-souches
[15] Yao S, Pan F, Prpic V & Wise GE. Differentiation of stem cells in the dental follicle. J Dent Res (2008) 87: 767-71.